где
![]() - агрегаты состоящие из i молекул (атомов),
- агрегаты состоящие из i молекул (атомов),
![]()
Агрегат, содержащий i=iкр молекул, рассматривается как зародыш критического размера, который в общем случае растет или уменьшается. Другие механизмы образования зародышей (например, одновременного столкновения iкр молекул или нескольких агрегатов размерами меньше критического) считаются вероятными только для потока, имеющего высокую плотность (например, для импульсных процессов испарения).
Образование сферического зародыша новой фазы, содержащего iкр молекул, сопровождается некоторым изменением свободной энергии ДGi, связанным с появлением определенной поверхности Sп и объема новой фазы V. В отсутствие полей и зарядов этот процесс можно описать уравнениями:
![]()
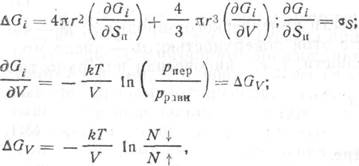
где r — радиус сферического зародыша, уS — поверхностная энергия, ДGV — изменение свободной энергии при конденсации, практически равное энергии испарения, рпер— давление перенасыщенного пара, рравн — равновесное давление пара, соответствующее температуре конденсации Т; N ↓ и N ↑— число молекул, движущихся к поверхности конденсации и испаряющихся с нее.
Следовательно, уравнение (3.2) можно представить в виде
![]()
![]()
![]()
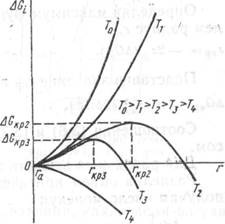
![]() Зависимость ДGi = f(r) для различных температур поверхности конденсации показана на рис. 3.1. Как видно из рисунка, свободная энергия ДGi растет с увеличением r до значения , а затем быстро убывает. Агрегаты радиусом r < rкр считаются нестабильными, а радиусом r > rкр — стабильными зародышами новой фазы. Последним соответствует уменьшение свободной энергии.
Зависимость ДGi = f(r) для различных температур поверхности конденсации показана на рис. 3.1. Как видно из рисунка, свободная энергия ДGi растет с увеличением r до значения , а затем быстро убывает. Агрегаты радиусом r < rкр считаются нестабильными, а радиусом r > rкр — стабильными зародышами новой фазы. Последним соответствует уменьшение свободной энергии.
![]() Определив максимум функции (3.5) из условия , найдем радиус rкр:
Определив максимум функции (3.5) из условия , найдем радиус rкр:
![]()
Подставив значение rкр в (3.5),
![]()
![]()
Соотношения (3.6) и (3.7) были впервые получены Дж. У. Гиббсом.
Для различных веществ rкр =1ч50 нм.
Разделив объем критического зародыша на молекулярный Vm, получим число молекул
![]()
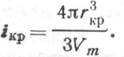
Из рис. 3.1 видно, что уравнение (3.5) справедливо в диапазоне температур от Т1 до Т4. Вне этого диапазона теорию Гиббса — Фольмера использовать нельзя.
Скорость образования зародыша
![]()
![]()
где Sп.кр—площадь поверхности критического зародыша; щ — частота столкновений молекул с этой поверхностью; ni — число молекул на единице этой поверхности, т. е. равновесная поверхностная концентрация молекул.
По изотерме Вант-Гоффа
![]()
где
n∑ — число молекул в паре.
Согласно уравнению Герца — Кнудсена частота столкновений
![]()
![]()
где ак — коэффициент конденсации; ри рк — давления насыщенных паров при температурах испарения и конденсации (т. е. испарителя и подложки). Следовательно, скорость образования зародышей
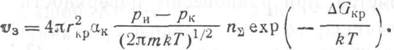
![]()
Уравнение (3.12) не учитывает ряда факторов. Например, не всякое столкновение молекулы с агрегатом ведет к ее конденсации и внедрению в агрегат. Поэтому выражение (3.12) следует умножить на равновесный фактор Z, учитывающий, какая доля из ударяющихся о поверхность молекул конденсируется. Обычно
Другое по теме:
Алгоритмы работы на сотовом мобильном телефоне Проектирование табличным методом алгоритмов работы на сотовом мобильном телефоне GA 628 Ericsson. Уточнения к проектированию: 1. Мобильный телефон подготовлен к работе и исправен. . Исходное состояние перед разработкой первого алг ...
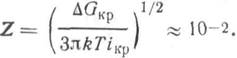 Перейти на страницу:
Перейти на страницу: